Pengertian unsur
Semua makhluk hidup tersusun dari
materi (matter). Materi (matter) adalah sesuatu
yang memiliki ukuran dan massa. Materi tersusun dari unsur (element).
Unsur (element) adalah substansi yang tidak bisa dipisahkan atau dipecah
lagi menjadi subtansi lain menggunakan reaksi kimia. Tiap-tiap unsur (element)
memiliki symbol dengan satu atau dua kata dari namanya. Sebagai contoh unsur natrium
diberi symbol dengan Na.
Pengertian Senyawa
Selanjutnya unsur-unsur tersebut
dapat saling berikatan membentuk suatu senyawa sehingga dapat dikatakan
bahwa senyawa adalah suatu substansi yang tersusun dari dua unsur atau
lebih dengan perbandingan tertentu. Contoh dari senyawa adalah NaCl, terdiri
dari unsur natrium (Na) dan unsur clorin
(Cl) dengan perbandingan 1 : 1. Contoh lain adalah adalah Air (H2O)
terdiri dari unsur hidrogen (A) dan oksigen O2 dengan perbandingan 2
: 1. Suatu senyawa memiliki karakteristik yang berbeda dengan unsur
penyusunnya, Natrium dalam bentuk murni merupakan metal dan clorin dalam
bentuk murni merupakan gas beracun, namun setelah membentuk NaCl
karakteristiknya tidak seperti natrium maupun clorin (Gambar 1).
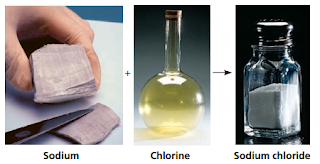 |
| Gambar 1. Natrium dalam bentuk murni merupakan metal dan clorin dalam bentuk murni merupakan gas beracun jika bereaksi membentuk NaCl yang merupakan senyawa yang dapat dimakan |
Unsur essensial dan trace element
Dari keseluruhan unsur yang ditemukan 20% - 25% diantaranya adalah unsur esensial. Unsur essensial adalah adalah unsur – unsur yang dibutuhkan oleh makhuk hidup termasuk dalam bereproduksi. Jumlah unsur essensial yang dibutuhkan oleh tiap-tiap organisme berbeda-beda, sebagai contoh manusia membutuhkan 25 unsur, sedangkan tanaman hanya membutuhkan 17 unsur.
Sebesar 96% dari makhluk hidup
tersusun dari oksigen (O2), hidrogen (H), carbon (C),
dan nitrogen (N). sisanya yaitu 4 %,
tersusun dari kalsium (Ca), fosfos (P), potassium (K), sulfur (S) dan beberapa
unsur lain. Ada beberapa unsur yang disebut dengan trace element.
Trace element adalah unsur-unsur yang diperlukan dalam jumlah
yang sangat kecil. Walaupun dibutuhkan
dalam jumlah kecil, tidak adanya trace element akan
menimbulkan beberapa gangguan dalam proses-proses metabolisme suatu makhluk
hidup. Sebagai contoh, unsur iodin (I), merupakan salah satu unsur yang
dibutuhkan oleh kelenjar untuk menghasilkan hormon. Manusia hanya membutuhkan
iodin (I) sebanyak 0,15 miligram (mg) per hari. Jika kekurangan iodin
(I), kelenjar tiroid akan mengalami pembengkakan.
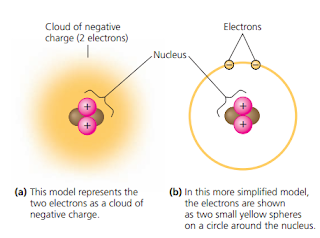
Bagian - bagian atom
Atom adalah unit terkecil dari unsur yang masih menunjukkan karakteristik suatu unsur. Atom mempunyai partikel – partikel penyusun yang disebut partikel subatomik (subatomic particles). Partikel subatomik yang banyak dikenal ada tiga macam, yaitu neutron, proton dan elektron. Proton memberikan muatan positif pada atom. Proton dan neutron saling menempel di tengah-tengah atom membentuk inti atom sedangkan elektron terus menerus berputar mengelilingi inti atom menghasilkan muatan negatik di sekitar inti atom (Gambar 2).
Neutron dan proton memiliki massa
yang hampir sama, yaitu 1,7 x 10-24 gram. Sedangkan massa elektron
adalah 1/2000 neutron atau protron sehingga massa elektron tidak dimasukkan
dalam penghitungan massa atom. Karena massa atom sangat kecil sehingga untuk
satuan massa untuk atom menggunakan satuan yang disebut dengan “dalton",
diambil dari nama John Dalton. John Dalton adalah ilmuwan Inggris yang
mengembangkan teori atom pada tahun 1800an. Satu Dalton sama dengan massa 1
neutron atau protron.
Baca juga
Proses Replikasi DNA
Kanker dan Pembelahan sel
Baca juga
Proses Replikasi DNA
Kanker dan Pembelahan sel
Nomer atom
Nomer atom adalah jumlah
proton dari suatu atom. Atom dari beberapa unsur memiliki perbedaan pada jumlah
partikel sub atomiknya. Satu atom sejenis selalu mempunyai jumlah proton yang
sama. Penulisan nomer atom menurut standart internasional adalah ditulis di
sebelah kiri dari simbol unsur. Sebagai contoh, untuk atom Helium
ditulis dengan 2He. Simbol
2He menunjukkan bawa atom helium tersebut mempunyai 2
proton di dalam inti atomnya. Oleh karena jumlah proton pada atom bermuatan
netral selalu sama dengan jumlah elektronnya, maka simbol 2He juga
menunjukkan bahwa atom helium bermuatan netral mempunyai 2 elektron.
Massa atom
Seperti yang telah dijelaskan sebelumnya diatas bahwa massa elektron hannya 1/2000 massa neutron atau protron sehingga dalam penghitungan massa atom, massa elektron diabaikan. Oleh karena itu massa atom adalah jumlah massa dari neutron dan proton dalam inti atom. Sebagai contoh, sodium mempunyai 11 proton dan berdasarkan perngukuran mempunyai massa atom sebesar 23 dalton, dituliskan dengan simbol 2311NA, tepatnya adalah 2.9898 dalton.Isotop
Isotop adalah suatu atom yang
mempunyai jumlah proton sama namun jumlah neutronnya berbeda. Atom-atom dari
suatu unsur selalu memiliki jumlah proton sama, tetapi bisa memiliki jumlah
neutron yang berbeda, itulah yang disebut dengan isotop. Walaupun
memiliki massa atom yang berbeda, isotop dari suatu unsur tetap akan mengalami
reaksi kimia yang sama. Sebagai contoh atom karbon, semua atom karbon memiliki
6 proton namun ada yang memiliki 6 neutron (6 12C), 7
neutron (6 13C) dan 8 neutron (6 14C).
Isotop atom karbon-12 (12C) merupakan atom karbon yang paling
melimpah yaitu sebanyak 99% dari keseluruhan atom yang ada di alam.
Isotop atom karbon-12 (12C)
dan atom karbon-13 (13C) merupakan isotop yang stabil sedangkan
Isotop atom karbon-14 (14C) adalah isotop yang tidak stabil atau
sering kali disebut dengan isotop radiaoktif. Atom radioaktif adalah
atom yang inti atomnya dapat meluruh secara spontan. Ketika atom radioaktif
meluruh, jumlah proton dalan atom tersebut berubah, sehingga unsur atom
tersebut juga berubah. Sebagai contoh ketika isotop atom karbon-14 meluruh,
atom karbon tersebut akan menjadi atom dari nitrogen (14N).
Isotop radioaktif sering kali
dimanfaatkan sebagai alat diagnosis dalam bidang kesehatan. Sel makhluk hidup
dapat menggunakan isotop radioaktif sebagaimana menggunakan isotop
non-radioaktif untuk reaksi-reaksi metabolisme dalam tubuh. Ketika masuk dalam
reaksi-reaksi metabolisme pada suatu organisme, isotop radioaktif dapat dilacak
keberadaannya. Contohnya adalah untuk diagnosa kerusakan ginjal. disuntik
isotop radio aktif ke dalam tubuh seseorang kemudian dilakukan pelacakan isotop
radio tersebut di dalam urinnya. Ketika terdapat isotop radio di dalam urin,
seseorang dapat diduga mengalami kerusakan pada ginjalnya.








0 komentar